式中︰F样品-加入LPPC时反应稀释液的荧光吸收强度;F对照-不加LPPC时反应稀释液的荧光吸收强度;F空白-不加LPPC不加Glu时反应稀释液的荧光吸收强度。
摘要:本试验分别研究了在乳清蛋白-葡萄糖和牛血清白蛋白-葡萄糖模拟生理体系中,荔枝果皮原花青素(Litchi pericarp procyanidins,LPPC)对美拉德反应和晚期糖基化终末产物(advanced glycation end products,AGEs)的抑制作用,以荧光性AGEs的强度为表征依据。结果表明,在乳清蛋白-葡萄糖模拟体系中孵育35 d时,LPPC对AGEs的抑制效果最强,达60.21±1.34%。LPPC浓度为1 mg/mL时,相对抑制率最大可达85.33±9.02%(显著高于维生素C(Vc),p<0.05)。在牛血清白蛋白-葡萄糖体系中,孵育35 d后LPPC对AGEs的相对抑制率最高达70.01±1.32%,且与LPPC浓度呈现正相关。当LPPC浓度为0.5 mg/mL时,抑制率最大为95.46±10.12%(显著高于氨基胍(AG),p<0.05)。不同pH值下蛋白质的稳定性研究表明,乳清蛋白在与LPPC长期孵育后,其热稳定性明显降低,再次提示了LPPC对美拉德反应的抑制作用。LPPC可作为一种天然的食品基质的AGEs抑制剂深度开发。
关键词:荔枝皮原花青素;模拟体系;晚期糖基化终末产物(AGEs);热稳定性
晚期糖基化终末产物(advanced glycation end products,AGEs),常指由还原糖羰基与氨基酸或蛋白质、脂质或核酸等大分子物质的游离氨基经过缩合、重排、裂解和氧化修饰等一系列非酶促反应后产生的一类稳定的化合物[1]。在诸多形成途径中,二羰基化合物和活性氧与蛋白质的反应最容易产生AGEs[2,3]。AGEs不仅可以直接影响细胞和组织功能、参与疾病的产生,也可以通过与特异受体结合发生反应来改变蛋白质和细胞功能,导致机体的病理变化[4]。随着年龄的增长,老年人、糖尿病与肾病病人的血浆和组织中都存在着高浓度的AGEs[5]。因此,寻找一些适合的AGEs抑制剂将有效改善AGEs并发症的形成和发生。
目前,广泛研究的AGEs抑制剂主要分为AGEs形成抑制剂和断裂剂两大类。其中,氨基胍(AG)是一种已达到临床应用阶段的AGEs形成抑制剂。它能捕获AGEs的前体物质如乙二醛、甲基乙二醛和葡萄糖酮醛等活性羰基化合物,形成无活性的替代物,从而抑制AGEs形成[6]。但AG对人体有较大的副作用,如引起胃肠道功能紊乱、破坏肺功能等[7]。因此,开发天然无副作用的AGEs抑制剂将成为热点。近年来,国内、外学者从天然产物中分离鉴定了包括黄酮类、蒽醌类和生物碱类等多种结构类型的AGEs抑制剂[8]。研究发现,类黄酮化合物对荧光性(如乙二醛-赖氨酸二聚体)和非荧光性(如羧甲基赖氨酸)AGEs均有抑制作用[2,9]。原花青素(procyanidins,PCs)作为黄酮类化合物的一种,已证实其是一种具有极强的抗氧化活性和自由基清除能力的天然膳食补充剂[10~12]。吴茜等(2015)研究表明,莲原花青素可通过清除活性羰基和调节血脂代谢,显著降低大鼠体内各脏器中AGEs的蓄积[13]。
荔枝是亚热带水果,原产我国南部,以广东和广西等地栽培为主。课题组前期研究表明,荔枝除了果肉鲜美以外,果皮因富含原花青素、花色苷、黄酮等多酚类化合物同样存在着巨大的开发价值,具有抗氧化、抑菌、降血脂及降尿酸等功效[14~16]。但目前为止,荔枝皮原花青素(LPPC)作为天然抗氧化剂和添加剂在食品中的应用还鲜见报导。活性羰基在高温加热食品和人体中均广泛存在,因此,基于LPPC优越的功能特性,本试验拟将其加入到乳清蛋白-葡萄糖和牛血清白蛋白-葡萄糖模拟体系中,研究LPPC对AGEs形成和美拉德反应的抑制作用,并监测反应后蛋白质热稳定性的变化。旨在开发一种食品基质的AGEs抑制剂。
1.1 原料和试剂
原料:荔枝品种白腊(Litchi Chinensis Sonn. cv. Baila),2013年7月采自广州。采后去皮,果壳于-18 ℃冰柜中保存。
试剂:牛血清白蛋白(BSA)、葡萄糖(Glu)、叠氮钠(NaN3)、Vc、磷酸二氢钠、磷酸氢二钠与葡萄糖等,分析纯,购于国药集团化学试剂有限公司;氨基胍(AG),购于美国Sigma公司;乳清蛋白(WPI),购于美国Hilmar Ingredients公司
1.2 仪器和设备
EL 104电子天平,梅特勒-托利多仪器(上海)有限公司;Beta2-8冻干机,德国CHRIST公司;RF 5301荧光分光光度计,日本SHIMADZU公司。
1.3 试验方法
1.3.1 荔枝皮原花青素提取物的制备
将一定量的荔枝皮撕碎后,加入70%乙醇固液萃取,料液比1:10(m/V);在60 ℃条件下浸提90 min后,抽滤得滤液,于 50 ℃的条件下旋转蒸发浓缩。将浓缩液过AB-8大孔树脂,用蒸馏水(10倍量)洗去不被吸附的杂质,再通过 70%乙醇收集洗脱[17]。50 ℃减压浓缩除去有机试剂后,真空冷冻干燥,即得荔枝皮原花青素提取物(Litchi pericarp procyanidins,LPPC),盐酸正丁醇法检测原花青素的含量>95%[18]。
1.3.2 不同孵育时间下LPPC对AGEs的抑制效果
分别用0.2 M PBS缓冲液(pH=7.4)配制WPI、BSA、Glu、NaN3和LPPC母液。将WPI-Glu模拟生理体系中AGEs的生成和抑制反应设置为:空白组,WPI+NaN3;对照组,WPI+Glu+NaN3;LPPC组:WPI+Glu+LPPC+NaN3。将BSA-Glu模拟生理体系的反应设置为:空白组,BSA+NaN3;对照组,BSA+Glu+NaN3;LPPC组:BSA+Glu+LPPC+NaN3。且反应体系中WPI、BSA、Glu、LPPC和NaN3的终浓度分别为5、5、36、0.2和0.195 mg/mL。将所有试管放于 37 ℃的隔水式培养箱中密封避光孵育,反应1、3、5、7、10、15、20、25、30、35、40、50和60 d后分别取样,进行荧光检测。每组设5个平行,以进行统计学分析。
1.3.3 不同浓度LPPC对AGEs的抑制效果
根据1.3.2的试验结果,拟定孵育35 d时LPPC对模拟体系中 AGEs的抑制效果最佳。分别设置与1.3.2相同的WPI-Glu和BSA-Glu模拟体系,调控其中LPPC组原花青素的最终浓度为0.01、0.02、0.04、0.05、0.1、0.2、0.5或 1 mg/mL,并增加 Vc(WPI+Glu+Vc+NaN3)和AG(BSA+Glu+AG+NaN3)阳性对照组,使Vc和AG浓度为1 mg/mL。再将所有试管放于 37 ℃的隔水式培养箱中密封避光孵育,反应35 d后取出,进行荧光检测。每组设5个平行,并进行统计学分析。
1.3.4 总荧光化合物的测定
取1 mL反应液,避光冷却至室温,临测前用PBS缓冲液稀释到4 mL,再通过荧光分光光度计检测其荧光值,以防止荧光猝灭效应。稀释后的反应液在激发波长370 nm,发射波长440 nm下测定荧光吸收强度[19,20]。
1.3.5 相对抑制率的计算
用上述方法测得荧光吸收强度后,取平均值,按下式计算LPPC对两个模拟体系中AGEs的相对抑制率。
式中︰F样品-加入LPPC时反应稀释液的荧光吸收强度;F对照-不加LPPC时反应稀释液的荧光吸收强度;F空白-不加LPPC不加Glu时反应稀释液的荧光吸收强度。
1.3.6 蛋白质稳定性分析
对两种蛋白(WPI和BSA)与葡萄糖和原花青素在长期孵育后的热稳定性进行分析:分别调节各组孵育35 d后的蛋白葡萄糖反应液至不同pH值(3~7),混合均匀后置于88 ℃水浴2 min,用冰水迅速冷却至室温,并观察其样品浑浊程度。
1.3.7 数据处理
采用Excel 12.0处理各组试验数据,结果表示为平均值±标准差;绘图和统计学分析通过Origin 8.0软件完成。
2.1 不同孵育时间下LPPC对AGEs形成的抑制作用
2.1.1 乳清蛋白-葡萄糖模拟体系中 LPPC对AGEs的抑制
随着乳清蛋白和葡萄糖加热时间的延长,其美拉德反应的程度会不断加剧,AGEs的生成量呈现上升趋势[21]。但如图1所示,在WPI-Glu模拟体系中,随着LPPC的加入,AGEs的生成被显著抑制了,但其相对抑制率不与反应体系中AGEs的产物浓度相关。在孵育的前3 d,未见原花青素对蛋白质和葡萄糖的相互作用产生影响;在反应的第5~35 d,LPPC对模拟体系中AGEs生成的抑制显著可见,并随着时间的变化逐渐上升,于反应进行到第 35 d时达到了最大值60.21±1.23%。极有可能与黄酮类化合物对美拉德反应的中间产物,特别是活性羰基化合物的抑制作用有关[2,9],因此其表现为荧光性AGEs浓度的降低和模拟体系荧光强度的减弱。从35 d之后,LPPC对AGEs的抑制率趋于稳定,并较之前而言有所降低,基本维持在53%左右。可能与长期孵育过程中多酚类化合物自身结构的不稳定性有关[22]。在中性PBS溶液中,原花青素的酚羟基会氧化成醌,其清除自由基的活性也随之减弱。
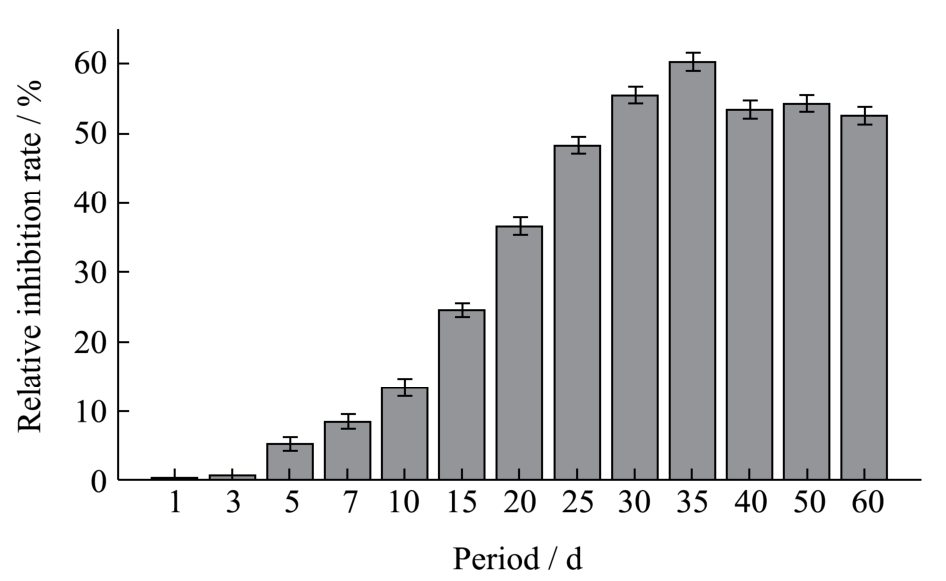
图1 不同孵育时间下LPPC对WPI-Glu模拟体系中AGEs形成的抑制效果
Fig.1 Inhibitory effect of LPPC on AGE formation in a WPI-Glu simulated system after different incubation durations
2.1.2 牛血清白蛋白-葡萄糖模拟体系中LPPC对AGEs的抑制
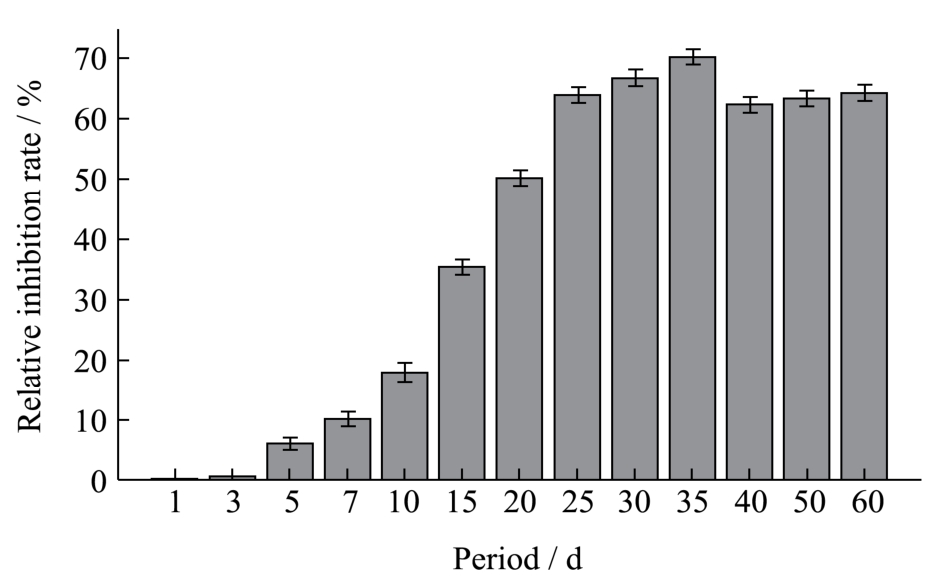
图2 不同孵育时间下LPPC对BSA-Glu模拟体系中AGEs形成的抑制效果
Fig.2 Inhibitory effect of LPPC on AGE formation in a BSA-Glu simulated system after different incubation durations
如图2所示,在BSA-Glu模拟体系中,随着孵育时间的延长,LPPC对AGEs的抑制作用与2.1.1呈现类似的趋势。在孵育的前 3 d,基本未见原花青素对BSA和Glu的美拉德反应产生影响;在反应的第5到25 d,LPPC对模拟体系中AGEs生成的抑制率随着时间的变化不断上升,随后趋于平缓,于反应进行到第35 d时达到最大,为70.01±1.32%。35 d以后,LPPC对AGEs的抑制作用稍有降低,与孵育25 d时效果接近,抑制率保持在60%左右。综上所述,结合两个模拟体系中孵育时间对LPPC抑制效果的影响,考虑到原花青素在溶液中的稳定性,初步拟定35 d为LPPC对蛋白质-葡萄糖模拟生理体系中 AGEs控制效果最佳的天数,并进行后续试验。
2.2 不同浓度LPPC对AGEs形成的抑制作用
2.2.1 乳清蛋白-葡萄糖模拟体系中LPPC的抑制作用
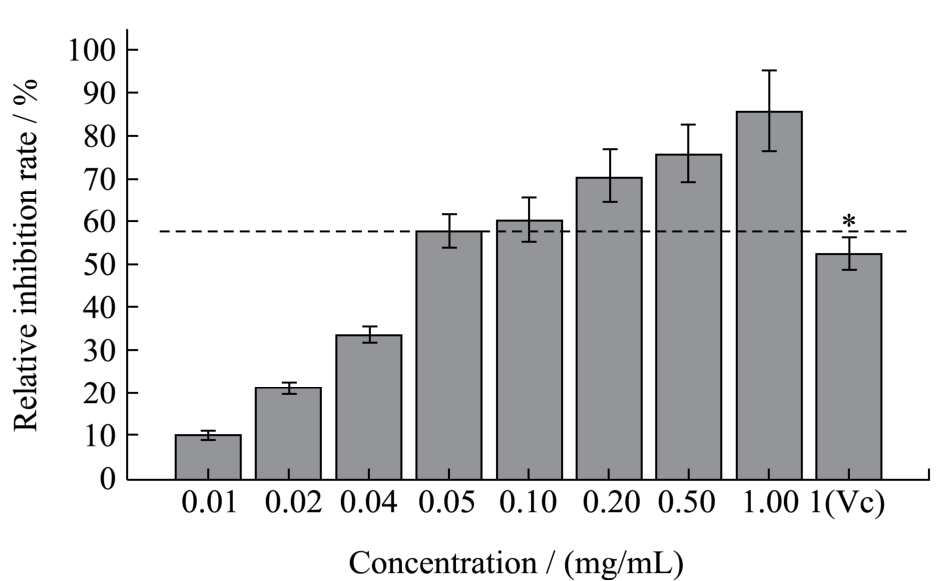
图3 不同浓度LPPC对WPI-Glu模拟体系中AGEs生成的抑制作用
Fig.3 Inhibitory effect of LPPC on AGE formation in a WPI-Glu simulated system in the presence of different levels of LPPC (Vc as control)
注:Vc作为阳性对照。
图3为37 ℃孵育35 d时,不同浓度LPPC(0.01~1 mg/mL)对WPI-Glu模拟生理体系中AGEs的抑制情况。如图所示,LPPC对AGEs的相对抑制率随浓度的增加不断变大,提示蛋白质与葡萄糖的非酶反应产物与LPPC的浓度呈现负相关。当LPPC浓度超过0.2 mg/mL时,其对AGEs的抑制率便显著高于1 mg/mL的阳性对照 Vc(p<0.05)。结果表明,原花青素对美拉德反应终产物的抑制和消除能力远远强于抗坏血酸,与前人对两者之间清除自由基和抗氧化能力的研究结果一致[23]。虽然Vc已是一种公认的食品添加剂和油脂抗氧化剂,但作为AGEs的抑制剂而言,其效果不及原花青素。1 mg/mL LPPC对AGEs的抑制作用可达到最大值85.33±10.02%。
2.2.2 牛血清白蛋白-葡萄糖模拟体系中LPPC的抑制作用
如图4所示,LPPC对BSA-Glu模拟体系中AGEs的相对抑制率随浓度的增加不断变大,特别是当LPPC的浓度在0.01~0.05 mg/mL之间时,浓度与抑制率显著正相关。当LPPC浓度超过0.1 mg/mL时,其对AGEs的抑制率即显著高于1 mg/mL的阳性对照AG(p<0.05)。当LPPC浓度达到0.5 mg/mL时,几乎可以完全抑制BSA与Glu反应产生的AGEs,抑制率为95.46±9.87%。1 mg/mL LPPC对AGEs的抑制率与其添加量为0.5 mg/mL时,无显著差异(p>0.05)和量效关系,考虑到LPPC在PBS中的溶解性和生物有效性,初步认为0.5 mg/mL LPPC是最佳的BSA-Glu模拟体系的AGEs抑制剂。倘若能将LPPC加以综合开发,使之成为AG的替代物或配合物,将极大降低其作为药物所产生的生理副作用。
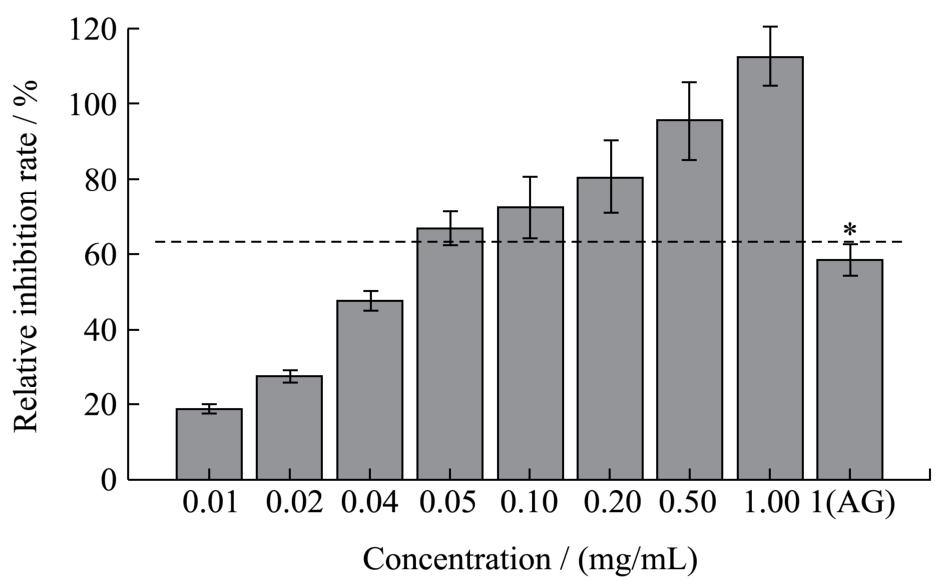
图4 不同浓度LPPC对BSA-Glu模拟体系中AGEs生成的抑制作用
Fig.4 Inhibitory effect of LPPC on AGE formation in a BSA-Glu simulated system in the presence of different concentrations of LPPC (AG as control)
注:AG作为阳性对照。
2.3 LPPC对模拟体系中蛋白质热稳定性的影响
蛋白质在加热过程中,会有比较大的聚集体产生,随着溶液中聚集体粒径的增加,溶液浊度升高,在直观图片中表现为浑浊现象[24]。美拉德反应产物能够显著抑制乳清分离蛋白在等电点附近的热聚集。这是由于亲水性糖链在蛋白位点上的接入,会增大溶液中蛋白质分子的空间位阻,相对削弱了蛋白质分子间电荷的静电吸引力,从而减少了蛋白热聚集程度,使溶液浊度降低[25,26]。图5所示为不同浓度LPPC处理乳清分离蛋白与葡萄糖反应产物在不同 pH值溶液中88 ℃水浴2 min后热稳定性的变化情况。由图可知,加热后原蛋白溶液的浊度在 pH=4的时候最大,在pH=3、5、6和7条件下,溶液保持澄清(瓶后的黑实线为便于观察溶液透明度设置,越清晰的看到黑实线说明溶液越澄清,否者越浑浊)。在WPI与Glu反应后,pH 4浊度有所降低,即热稳定性有所增加,其他pH条件下基本上不变。相比较而言,美拉德反应产物在整个pH范围(3~7)内的热聚集程度降低;同样的结论也可以从BSA与Glucose的反应结果中得到,如图6所示。实验结果表明在偏酸或偏碱条件乳清分离蛋白的热稳定性较好。

图5 WPI与Glu反应产物在不同pH值溶液在88 ℃水浴2 min后浑浊情况
Fig.5 Visual appearance of WPI-Glu products at 88 ℃ for 2 min at different pH levels
注:a表示WPI+NaN3;b表示WPI+Glu+NaN3;c表示WPI+Glu+LPPC (0.1 mg/mL)+NaN3;d表示WPI+Glu+LPPC (1 mg/mL)+NaN3。

图6 BSA与Glu反应产物在不同pH值溶液在88 ℃水浴2 min后浑浊情况
Fig.6 Visual appearance of BSA-Glu products at 88 ℃ for 2 min at different pH levels
注:a表示BSA+NaN3;b表示BSA+Glu+NaN3;c表示BSA+Glu+LPPC (0.1mg/mL)+NaN3;d表示 BSA+Glu+LPPC (1mg/mL)+NaN3。
在WPI-Glu反应体系中加入0.1 mg/mL LPPC时,经过88 ℃处理2 min,在pH 3和4出现浑浊现象,即热稳定性降低,其他pH条件下基本上不变。结合前面的分析结果可知,0.1 mg/mL LPPC对WPI与Glu的美拉德反应有所抑制,即阻碍了糖链在蛋白位点上的接入。然而在BSA与Glu反应体系中抑制效果观察不显著。在WPI与Glu反应体系中加入1 mg/mL LPPC时,经过88 ℃处理2 min,在pH 3~7出现浑浊现象,可能原因是1)LPPC对美拉德反应的抑制;2)高浓度LPPC对蛋白质分子间电荷的静电有屏蔽作用,促进了乳清分离蛋白的聚沉。
3.1 荔枝果皮原花青素无论是在乳清蛋白-葡萄糖还是在牛血清白蛋白-葡萄糖模拟生理体系中,都能显著抑制晚期糖基化终产物(AGEs)的产生。孵育时间和原花青素的浓度对抑制率具有调控作用。
3.2 在WPI-Glucose模拟体系中,随着孵育时间的不断推移,LPPC对AGEs的相对抑制率不断变大,于35 d时达到最高为60.21±1.23%;反应40~60 d时,抑制率有所降低,基本维持在53%左右。将不同浓度的LPPC(0.01~1 mg/mL)添加至模拟体系中共同孵育35 d,溶液中AGEs的生成量与原花青素浓度呈现负相关。当LPPC浓度为1 mg/mL时,其对体系中AGEs的抑制率最大,达到85.33±10.02%,效果显著强于相同浓度的Vc(抑制率52.26±4.01%)。
3.3 在BSA-Glucose模拟体系中,反应时间达到35 d时,LPPC对AGEs的相对抑制率最大,达到70.01± 1.32%;之后20 d趋于平缓,主要维持在60%左右。当LPPC浓度为0.5 mg/mL,与BSA和Glu共同孵育,几乎可以完全抑制美拉德反应的发生,对AGEs的抑制率为95.46±9.87%。而此时,阳性对照AG对AGEs的抑制作用仅为58.29±4.12%。提示LPPC可以作为一种天然的食品基质的AGEs抑制剂深度开发。
3.4 原花青素在与WPI和Glu的长期孵育过程中,当LPPC浓度为0.1 mg/mL时,经过88 ℃处理2 min,仅在pH 3和4出现浑浊现象,即热稳定性降低;而当LPPC浓度增大至1 mg/mL时,经过相同处理,在pH 3~7间均出现浑浊现象。再次提示了原花青素对美拉德反应的抑制作用。
参考文献:
[1] Singh R, Barden A, Mori T, et al. Advanced glycation end-products: a review [J]. Diabetologia, 2001, 44(2): 129-146
[2] Wu C H, Huang S M, Lin J A, et al. Inhibition of advanced glycation endproduct formation by foodstuffs [J]. Food and Function, 2011, 2(5): 224-234
[3] Nemet I, Varga-Defterdarovic L, Turk Z. Methylglyoxal in food and living organisms [J]. Molecular Nutrition and Food Research, 2006, 50(12): 1105-1117
[4] Hyun Young K, Takuya O, Takako Y. Beneficial effects of Chinese prescription Kangen-karyu on diabetes associated with hyperlipidemia, advanced glycation endproducts, and oxidative stress in streptozotocin-induced diabetic rats [J]. Journal of Ethnopharmacology, 2009, 124(2): 263-269
[5] Ahmed N. Advanced glycation endproducts-role in pathology of diabetic complications [J]. Diabetes Research and Clinical Practice, 2005, 67(1): 3-21
[6] 刘翼翔,景浩.体内美拉德反应及其产物的病理作用研究[J].食品与生物技术学报,2010,29(2):161-166 LIU Yi-xiang, JING Hao. Advances in pathological effects of maillard reaction products in vivo [J]. Journal of Food Science and Biotechnology, 2010, 29(2): 161-166
[7] 阳冠明,李树全,叶司原,等.氨基胍对阿霉素所致大鼠心肌毒性损伤的影响[J].中国药理学通报,2002,18(5):552-555 YANG Guan-ming, LI Shu-quan, YE Si-yuan, et al. Effect of aminoguanidine on adriamycin induced cardiotoxic injury in rats [J]. Chinese Pharmacological Bulletin, 2002, 18(5): 552-555
[8] 周燕琼.植物多酚抑制食品中晚期糖基化终末产物的形成的作用机理研究[D].无锡:江南大学,2015 ZHOU Yan-qiong. Study on the inhibition effects and mechanism of plant polyphenol on advanced glycation end-products in food [D]. Wuxi: Jiangnan University, 2015
[9] 梁海燕,古德祥,木苗直秀,等.类黄酮化合物对糖基化反应终产物AGE的抑制作用[J].天然产物研究与开发,2001, 14(2):14-18 LIANG Hai-yan, GU De-xiang, MU Miao-zhi xiu, et al. Inhibitory effect of flavonoids on advanced glycation end products [J]. Natural Product Research and Development, 2001, 14(2): 14-18
[10] Noda Y, Anzai K, Mori A, et al. Hydroxyl and superoxide anion radical scavenging activities of natural source antioxidants using the computerized JES-FR30 ESR spectrometer system [J]. Biochem Mol. Biol. Int, 1997, 42(1): 35-44
[11] RiceEvans C, Spencer J P E, Schroeter H, et al. Bioavailability of flavonoids and potential bioactive forms in vivo: drug metabolism and drug interactions [J]. Drug Metabolism & Drug Interactions, 2000, 17(1-4): 291-310
[12] Lie-Chwen L, Yuh-Chi K, Cheng-Jen C. Immunomodulatory proanthocyanidins from Ecdysanthera utilis [J]. Journal of Natural Products, 2002, 65(4): 505-508
[13] Wu Q, Li S, Li X, et al. Inhibition of advanced glycation end product formation by lotus seedpod oligomeric procyanidins through RAGE-MAPK signaling and NF-Kappa B activation in high-fat diet rats [J]. Journal of Agricultural and Food Chemistry, 2015, 63: 6989-6998
[14] Liu L, Xie B, Cao S, et al. A-type procyanidins from Litchi chinensis pericarp with antioxidant activity [J]. Food Chemistry, 2007, 105(4): 1446-1451
[15] Li S, Xiao J, Chen L, et al. Identification of a-series oligomeric procyanidins from pericarp of litchi chinensis by Ft-Icr-Ms and Lc-Ms [J]. Food Chemistry, 2012, 135(1): 31-38
[16] Moriwaki Y, Okuda C, Yamamoto A, et al. Effects of oligonol, an oligomerized polyphenol formulated from lychee fruit, on serum concentration and urinary excretion of uric acid [J]. Journal of Functional Foods, 2011, 3(1): 13-16
[17] 周玮婧.荔枝皮原花青素的提取、纯化以及抗氧化活性研究[D].武汉:华中农业大学,2010 ZHOU Wei-jing. Extraction, purification and antioxidation of procyanidins from Litchi chinensis Pericarp [D]. Wuhan: Huangzhong Agricultural University, 2010
[18] Porter L J, Hrstich L N, Chan B G. The conversion of procyanidins and prodelphinidins to cyanidin and delphinidin [J]. Phytochemistry, 1985, 25(1): 223-230
[19] Wu Q, Chen H, Lv Z, et al. Oligomeric procyanidins of lotus seedpod inhibits the formation of advanced glycation end-products by scavenging reactive carbonyls [J]. Food Chemistry, 2013, 138(2-3): 1493-1502
[20] Wu Q, Li S, Li X, et al. A significant inhibitory effect on advanced glycation end product formation by catechin as the major metabolite of lotus seedpod oligomeric procyanidins [J]. Nutrients, 2014, 6(8): 3230-3244
[21] Silvan J M, Assar S H, Srey C, et al. Control of the Maillard reaction by ferulic acid [J]. Food Chemistry, 2011, 128(1): 208-213[22] 汪志慧,孙智达,谢笔钧.莲房原花青素的稳定性及热降解动力学研究[J].食品科学,2011,32(7):77-82 WANG Zhi-hui, SUN Zhi-da, XIE Bi-jun. Optimization of the double-enzymatic extraction of procyanidins from lotus seed pods using response surface methodology [J]. Food Science, 2011, 32(7): 77-82
[23] 高羽,董志.原花青素的药理学研究现状[J].中国中药杂志,2009,34(6):651-655 GAO Yu, DONG Zhi. Progress on study of pharmacological effects of procyanidins [J]. China Journal of Chinese Materia Medica, 2009, 34(6): 651-655
[24] Damodaran S, Kinsella J E. Effect of conglycinin on the thermal aggregation of glycinin [J]. Journal of Agricultural and Food Chemistry, 1982, 30(5): 812-817
[25] Liu G, Zhong Q. Glycation of whey protein to provide steric hindrance against thermal aggregation [J]. Journal of Agricultural and Food Chemistry, 2012, 60(38): 9754-9762
[26] Liu G, Zhong Q. Thermal aggregation properties of whey protein glycated with various saccharides [J]. Food Hydrocolloids, 2013, 32(1): 87-96
Inhibitory Effect of Litchi Pericarp Procyanidins on Maillard Reactions in Protein-based Systems
Abstract:The inhibitory effect of litchi pericarp procyanidins (LPPC) on the Maillard reaction and advanced glycation end product (AGE) formation was studied in whey protein (WPI)-glucose (Glu) and bovine serum albumin (BSA)-Glu simulations systems, and characterization was based on the fluorescence intensity of AGEs. The results indicated that the maximum inhibitory rate of LPPC on AGE formation in the WPI-Glu system after incubation for 35 d was 60.21±1.34%. Furthermore, at a concentration of 1 mg/mL, the inhibitory rate of LPPC reached a maximum of 85.33±9.02%, significantly higher than that of vitamin C (Vc, p<0.05). In the BSA-Glu system, the maximum inhibitory rate of LPPC on AGE formation after incubation for 35 days reached 70.01±1.32%, and showed a positive correlation with LPPC concentration. At an LPPC concentration of 0.5 mg/mL, the inhibition of AGE formation reached 95.46±10.12%, which was significantly higher than that of aminoguanidine (AG, p<0.05). Studies of protein stability at different pH values suggested that the thermal stability of WPI was significantly decreased after 35 d of incubation with LPPC, further implying the inhibitory effect of LPPC on the Maillard reaction. Overall, LPPC could serve as a food resource with natural AGE inhibition.
Key words:Litchi pericarp procyanidins (LPPC); simulated system; advanced glycation end products (AGEs); thermal stability
文章篇号:1673-9078(2017)1-68-73
DOI:10.13982/j.mfst.1673-9078.2017.1.011
收稿日期:2015-08-27
基金项目:国家自然科学基金项目(31401640);武汉市青年科技晨光计划(2014072704011258);中国教育部第48批留学归国人员科研启动基金项目作者简介:李书艺(1987-),女,博士,讲师,研究方向:功能食品与天然产物化学