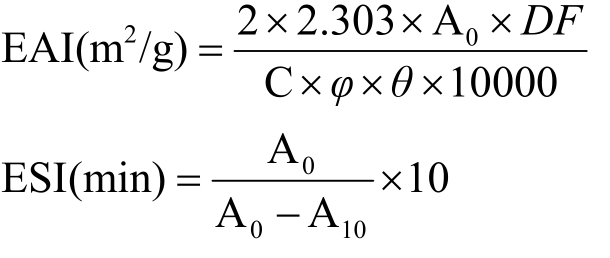
DF为乳液稀释倍数,公式中DF=100;C为蛋白浓度,g/mL;φ为光程,φ=0.01 m;θ为油相所占分数,θ=0.25;A0和A10分别为0 min和10 min时的吸光度。
摘要:本文研究了核桃蛋白及其主要组分谷蛋白和球蛋白的物化特性与功能特性。研究表明:核桃蛋白的变性温度Td(104.42 ℃)和热焓值ΔH(12.93 J/g)都显著高于谷蛋白和球蛋白的变性温度、热焓值(p<0.05),且变性协同性较好;谷蛋白和球蛋白的巯基含量较核桃蛋白高,且大部分巯基暴露在表面,而核桃蛋白巯基主要包埋在分子内部且二硫键含量为三者中最高(为5.2 μmol/g);由荧光结果表明核桃蛋白有着较致密的三级结构,而球蛋白结构相对较疏松;表面疏水性指数由高至低依次为谷蛋白、核桃蛋白和球蛋白。谷蛋白表现出较高的乳化活性,但乳化稳定性最差,核桃蛋白的乳化活性较谷蛋白稍差,但乳化稳定性最好;球蛋白的巯基和二硫键含量较高,结构松散,作用位点较多,形成的凝胶强度高,其次是核桃蛋白和谷蛋白。
关键词:核桃蛋白;谷蛋白;球蛋白;物化特性;功能特性
我国是世界上最大的核桃生产国和消费国,目前核桃加工仍以榨油为主。核桃油生产过程产生了大量脱脂粕,主要用作饲料和肥料,仅少量用于生产核桃蛋白粉、核桃乳等初级产品,利用率和附加值均比较低[1]。核桃蛋白作为脱脂粕的主要成分,是一种大宗的蛋白质资源,要充分利用这一重要的植物蛋白质资源,首先就必须了解其结构特征、物化和功能特性。许多学者已经做了相关研究,但主要集中在核桃蛋白的分离方法和简单的理化性质,酶解制备各种活性肽,核桃蛋白产品的制备方法和产品特点等方面[1~4];从研 究的侧重点方面看,对核桃蛋白的结构、组成和功能改性方面的研究相对较少,且研究的深度不够[5]。我国核桃品种较多,产地和种植条件的差异比较大,脱脂粕成分较复杂,加大了利用核桃脱脂粕的难度,造成了资源的浪费。因此,加深对核桃蛋白的相关研究具有重要的理论和实践意义。
依据结构决定功能的原理,蛋白质功能性质如溶解性、乳化性、起泡性、凝胶性与其分子量分布、亚基的大小/组成、亚基的解离/聚合性质、分子柔性、表面电荷和二硫键含量及其热稳定性和亲疏水性等参数有着密切的关系[6]。而核桃谷蛋白和核桃球蛋白(以下分别称为谷蛋白和球蛋白)作为核桃蛋白的两种主要组分,构成核桃蛋白含量的85%以上[3]。本文采用碱溶酸沉和Osborne蛋白分级提取方法,制备出核桃蛋白、谷蛋白和球蛋白,并对其物化特性与功能特性进行研究,从结构和功能的角度揭示三种蛋白的异同点,从而为深刻认识核桃蛋白这种资源提供思路。
1.1 材料与试剂
脱脂核桃粕由河南天纤益康科技有限公司提供;核桃蛋白、谷蛋白和球蛋白为自制(蛋白质含量分别为 86.9%、90.3%和 87.2%);1-苯胺基-8-萘磺酸(ANS),Sigma公司;5-5’-二硫代-2-硝基苯甲酸(DTNB),Sigma公司;甘氨酸,上海伯奥生物科技有限公司;乙二胺四乙酸(EDTA),Sigma公司;其他试剂均为分析纯,市售。
1.2 仪器与设备
FA 1104型分析天平,上海精密科学仪器有限公司;GL-21M高速冷冻离心机,长沙湘仪离心机仪器有限公司;BHW-IV型精密恒温水箱,北京朝阳航信医疗器材厂;悬臂式搅拌器-RW20,德国IKA公司;TA Q200型差示扫描量热分析仪,美国TA仪器公司;T25高速分散机,德国IKA公司;Lumina荧光分光光度计,美国Thermo Scientific公司;pH计,梅特勒-托利多公司;751型分光光度计,上海第三分析仪器厂;HAAKE MARS Ⅲ流变仪,德国赛默飞世尔公司。
1.3 实验方法
1.3.1 核桃蛋白及其组分的制备
碱溶酸沉法[5]提取核桃蛋白:向核桃脱脂粉中按1:12比例加入去离子水,用1 M氢氧化钠调pH到9,在55 ℃水浴下搅拌2 h,离心取上清液,用1 M盐酸调pH 为4.5,搅拌1 h,离心取沉淀,水洗至中性,冻干。
谷蛋白及球蛋白提取方法:参照 Sze-Tao[3]关于Osborne分级提取核桃蛋白组分的方法。
1.3.2 热学特性分析
取2 mg蛋白于铝盒中,再加10 μL去离子水,压盒,4 ℃冰箱中放置过夜平衡。以空铝盒为空白对照,设置如下参数:温度扫描范围:0~180 ℃;升温速率:5 ℃/min;保护气氮气流速:50 mL/min。用软件Universal Analysis 2000计算蛋白质的变性温度(Td)、半峰宽(ΔT1/2)和变性热焓值(ΔH)。
1.3.3 巯基含量测定
试剂A:精确称取10.418 g Tris,6.756 g甘氨酸,1.489 g EDTA二钠,480.48 g尿素,加去离子水定容至1000 mL,调节pH值到8.0。
试剂B:试剂A中不加480.48 g尿素。
试剂C:称取4 mg DTNB试剂溶于1 mL试剂B中。
暴露巯基的测定:称取15 mg蛋白溶于5.0 mL试剂B中,添加50 μL C溶液,剧烈震荡后25 ℃水浴保温1 h,于25 ℃离心(10000 g,20 min),上清液在412 nm波长下测定吸光值,测量三次。该条件下的消光系数为13600 M-1·cm-1,106μ/(L·cm)是单位转化的系数。
总巯基的测定:称取15 mg蛋白溶于5.0 mL试剂A中,其余步骤如上。
巯基含量的计算公式如下:
SH(μmol/g)=73.53×A412×D/C
式中,73.53 μmol/L=106μ/(L·cm)/13600 M-1·cm-1;A41:样品吸光值;D:上清液稀释倍数;C:上清液蛋白含量(mg/mL)。
1.3.4 二硫键含量测定
NTSB合成:0.1 g DTNB溶于10 mL、1 mol/L Na2SO3溶液中,调节pH值至7.5,添加50 μL、0.1 mol/L CuSO4的氨溶液,保持38 ℃。涡旋振荡至溶液从亮红色变为淡黄色,-20 ℃保存备用。
NTSB测试液:将 NTSB和新配置的 0.2 M Tris-base缓冲液(0.1 mol/L Na2SO3,10 mmol/L EDTA和3 mol/L异硫酸胍)按1:100(V/V)稀释,调节pH值至9.5即可。
二硫键的测定:50 mg蛋白质分散于 100 μL Tris-base缓冲液中,再加入到3 mL新配的NTSB测试液中,25 ℃保温1 h,再离心(13600 g,10 min),以NTSB测试液为参比,上清液在412 nm比色。
二硫键计算公式同上。
1.3.5 荧光光谱分析
采用Thermo Scientific公司的Lumina荧光分光光度计测定蛋白的荧光光谱。用10 mmol/L、pH 7.0磷酸盐缓冲液溶解蛋白,配成浓度为0.1 mg/mL蛋白溶液。
内源荧光:激发波长 290 nm,扫描发散光谱为300~400 nm,激发和发射狭缝宽均为5 nm,PMT电压500 V,扫描速度300 nm/min,扫描间隔时间20 ms,反应时间0.1 s。
外源荧光:用10 mmol/L、pH 7.0磷酸盐缓冲液溶解ANS配成8 mM的溶液,取10 μL ANS溶液加在2 mL蛋白溶液中,振荡摇匀,避光静置15 min。激发波长390 nm,扫描发散光谱为400~600 nm,激发和发射狭缝宽均为5 nm,扫描速度300 nm/min,扫描间隔时间20 ms,反应时间0.1 s。
1.3.6 表面疏水性的测定
将蛋白质样品溶解于10 mmol/L、pH为7.0的磷酸盐缓冲液中,分别配成浓度为0.15、0.3、0.45、0.6和0.75 mg/mL的蛋白质溶液。取蛋白溶液4 mL,加入20 μL、8 mmol/L过膜的ANS溶液,振荡均匀,静置10 min后测定荧光强度(FI)。
测定条件:激发波长 λex=390 nm,发射波长λem=470 nm,激发和发射狭缝宽均为5 nm。以荧光强度对蛋白质浓度作曲线,曲线初始阶段的斜率即为表面疏水性指数(H0)。
1.3.7 氮溶解指数的测定
配制1 wt%的蛋白质溶液,室温下搅拌2 h,然后用一定浓度的HCl或NaOH调节溶液的pH值为2~10,待溶液pH稳定后再搅拌30 min,于室温下离心(10000 g,20 min)。采用凯氏定氮法测定上清液蛋白质浓度,蛋白质的溶解度表示为上清液蛋白浓度占总蛋白浓度的百分比。每个样品测定三次。
1.3.8 乳化特性的测定
先将蛋白分散于去离子水中配成2 wt%溶液,调节pH为2~10。然后向15 mL调好pH的蛋白质溶液中加入5 mL大豆油,在20000 r/min的速度下均质1 min,迅速从测试管底部取出50 μL乳液,用0.1%的SDS稀释100倍后,于500 nm处比色。乳化活性指数(EAI,m2/g)和乳化稳定性指数(ESI,min)计算公式如下:
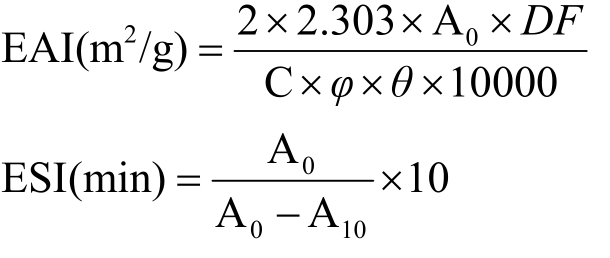
DF为乳液稀释倍数,公式中DF=100;C为蛋白浓度,g/mL;φ为光程,φ=0.01 m;θ为油相所占分数,θ=0.25;A0和A10分别为0 min和10 min时的吸光度。
1.3.9 蛋白凝胶性质的测定
实验于HAAKE MARS Ⅲ流变仪中进行,选用P35 TiL型号的转子,测试间距1 mm。先将蛋白用10 mM、pH 7.0的磷酸盐缓冲液配成10 wt%的溶液,保证蛋白全部溶解。将样品置于平行板间,小心除去过量的溶液,在平板边缘涂上一层硅油,防止水分蒸发。
温度扫描:起始温度25 ℃,以2 ℃/min的升温速度加热至95 ℃,在95 ℃保持30 min,后以2 ℃/min的降温速度冷却至25 ℃,整个过程设置频率为1 Hz,应变1%,测定整个过程的G'(弹性模量),G"(粘性模量)。
频率扫描:温度扫描结束后,保持25 ℃,于1%应变下(经应力扫描确定的)对凝胶进行频率(0.1~10 Hz)扫描,测定整个过程的G',G"。
1.3.10 数据分析
采用软件SSPS 20.0进行显著性分析,差异显著性p<0.05。
2.1 蛋白热学特性分析
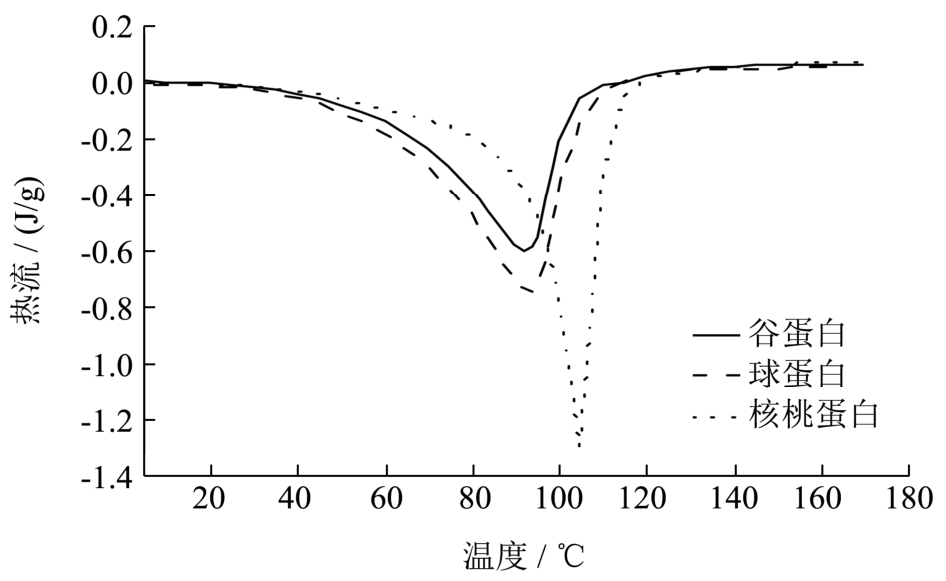
图1 核桃蛋白及其组分的DSC图谱
Fig.1 DSC patterns of walnut protein and its fractions
表1 核桃蛋白及其组分的热学特性
Table 1 Thermal properties of walnut protein and its fractions

注:用Duncan法进行显著性分析。同列标有不同小写字母者表示组间差异显著(p<0.05);标有相同小写字母者表示组间差异不显著(p>0.05)。
?
图1为核桃蛋白及其组分的热差示扫描(DSC)图谱,热学参数见表 1。从图可知,核桃蛋白及其组分的热差示扫描图谱都只有一个平滑的吸热峰,无杂质峰,这说明本实验所用样品的蛋白质含量比较高。由表1可知,核桃蛋白、谷蛋白和球蛋白的变性温度分别为104.42 ℃、92.79 ℃和93.87 ℃,核桃蛋白的变性温度比谷蛋白、球蛋白的变性温度高,说明核桃蛋白具有更高的热稳定性,而谷蛋白和球蛋白的热学特性指标比较接近。通过热焓值(ΔH)的测定,可反映蛋白质的变性状况。热焓值越大,说明维持蛋白质结构的作用力越大,蛋白质有序结构越多,即蛋白质热稳定性越好[7]。核桃蛋白的热焓值为12.93 J/g,大于谷蛋白的7.76 J/g和球蛋白的10.71 J/g,表明核桃蛋白比其两种主要组分更稳定,对热相对不敏感,这可能与蛋白提取过程中的处理有关。谷蛋白的半峰宽ΔTd为15.32 ℃,球蛋白的半峰宽为17.36 ℃,都显著大于核桃蛋白的半峰宽8.32 ℃,这说明核桃蛋白结构比较致密有序,具有较好的变性协同性,可以在较窄的温度范围内完全变性。
2.2 巯基/二硫键含量
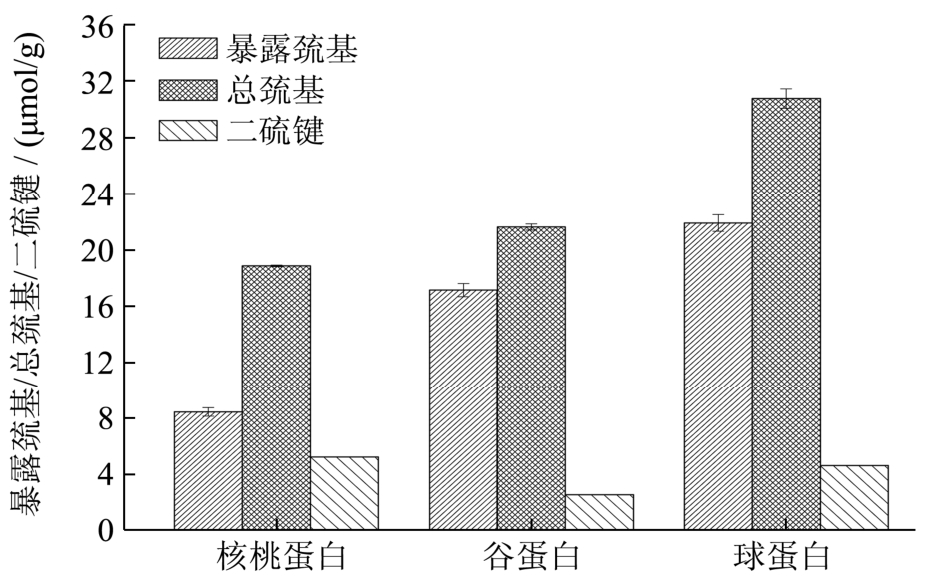
图2 核桃蛋白及其组分的总巯基、暴露巯基和二硫键含量
Fig.2 Total and exposed sulfhydryl content and disulfide bond
content of walnut protein and its fractions
核桃蛋白及其组分的暴露巯基、总巯基和二硫键含量如图2所示。核桃蛋白的暴露巯基和总巯基含量分别为8.45 μmol/g、18.85 μmol/g,谷蛋白的含量分别为17.14 μmol/g和21.61 μmol/g,球蛋白的含量分别为21.90 μmol/g和30.76 μmol/g。可知谷蛋白和球蛋白的大部分巯基都暴露在蛋白质表面,而核桃蛋白的巯基主要包埋在分子内部。可知蛋白质结构特征并不是其组分结构参数的简单叠加,因为蛋白质组分间存在着一定的相互作用(协同作用或者抗拮作用),蛋白的提取过程也会改变蛋白质的结构[5]。巯基和二硫键是维持蛋白质空间结构和赋予其一定功能性质的重要化学键[8],这些键发生断裂或者重新键合,蛋白质高级结构发生变化,以调节蛋白特定的功能和活性。核桃蛋白的二硫键含量为5.20 μmol/g,三种蛋白中最高,这可能是核桃蛋白的变性温度和热焓值比较高的一个原因。
2.3 荧光光谱分析(内源荧光/外源荧光)
核桃蛋白及其组分的内源荧光如图3所示,谷蛋白的荧光强度最大,核桃蛋白次之,球蛋白的荧光强度最低;核桃蛋白、谷蛋白和球蛋白的荧光峰λmax分别在340.5 nm、345.4 nm和352.4 nm处,谷蛋白和球蛋白相对于核桃蛋白的荧光峰发生了红移。这说明核桃蛋白分子内部的色氨酸残基位于较疏水的微环境中,核桃蛋白内部的疏水性强于谷蛋白和球蛋白,其三级结构比较致密,而球蛋白结构相对较疏松[6]。这也可说明核桃蛋白的变性温度和热焓值比较高的原因。
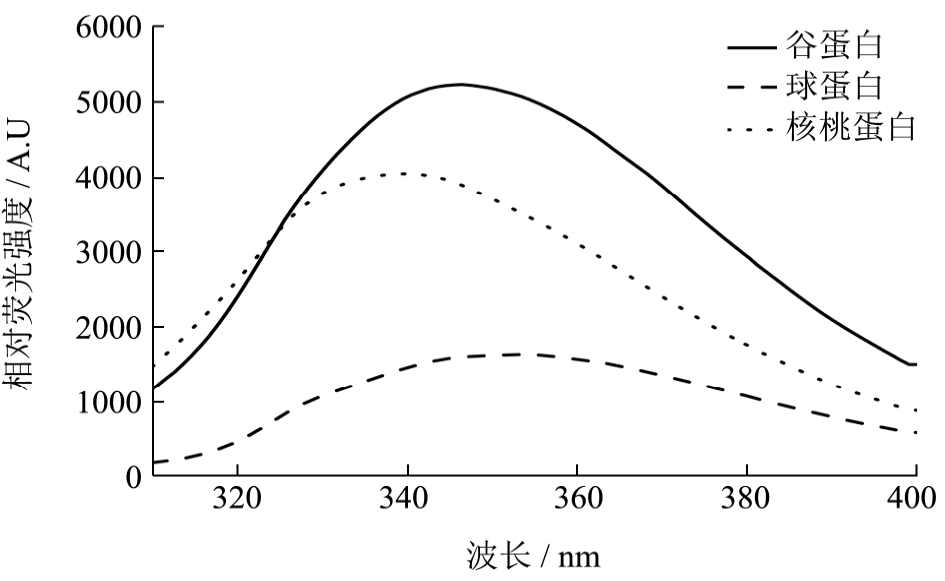
图3 核桃蛋白及其组分的内源荧光发射光谱
Fig.3 Intrinsic fluorescence emission spectra of walnut protein and its fractions
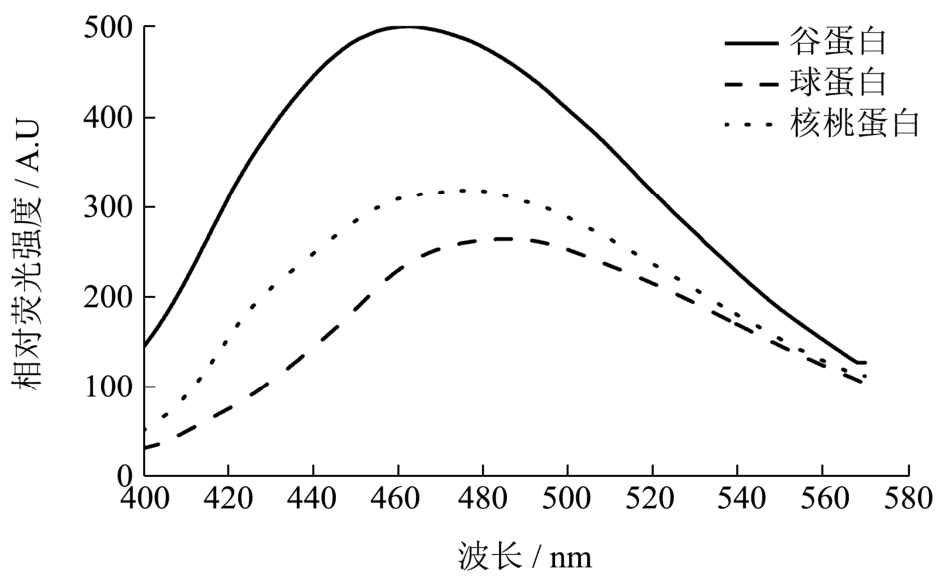
图4 核桃蛋白及其组分的外源荧光发射光谱
Fig.4 Extrinsic fluorescence emission spectra of walnut protein and its fractions
图4中谷蛋白、核桃蛋白、球蛋白和ANS结合后的荧光峰分别在462.8 nm、476.6 nm和486.9 nm处,而单纯ANS水溶液的荧光峰出现在509 nm处,说明三种蛋白的荧光峰都发生了蓝移。ANS是一种阴离子非极性荧光探针,它结合到蛋白质的非极性区域时,荧光会随着微环境疏水性的增加而发生蓝移,同时荧光强度也随之增强[9]。核桃蛋白和谷蛋白相对于球蛋白荧光峰蓝移现象更加明显,核桃蛋白和谷蛋白与ANS结合的复合物荧光强度比较大,这都表明核桃蛋白和谷蛋白的疏水性较强,且谷蛋白疏水性大于核桃蛋白。经测定和计算可知,谷蛋白、核桃蛋白和球蛋白的表面疏水性指数分别为1230、963和634,这和蛋白外源荧光的分析结果相吻合。蛋白质表面疏水性指数是一个反映蛋白质特性的重要参数,对蛋白的乳化和界面性质有着重要的影响[10]。
2.4 氮溶解指数
核桃蛋白及其组分氮溶解指数与pH值的关系如图5所示,为U型曲线,这与Sze-Tao[3]和Mao[5]等人研究的核桃蛋白溶解度曲线比较相似。在pH值
4.0~5.0内,三种蛋白的氮溶指数均最低;在 pH值2.0~4.0内,球蛋白的氮溶解指数比核桃蛋白和谷蛋白略高,而在pH值6.0~10.0内球蛋白的氮溶解指数低于两者。核桃蛋白和谷蛋白的氮溶解指数比较接近,这可能是因为核桃蛋白主要是由谷蛋白构成,因此溶解性上比较相似。含有较多酸性氨基酸的蛋白质在碱性条件下更容易溶解,而核桃球蛋白和谷蛋白中酸性氨基酸的含量高于球蛋白酸性氨基酸的量(氨基酸分析数据未给出),所以球蛋白在碱性条件下的溶解度较低。
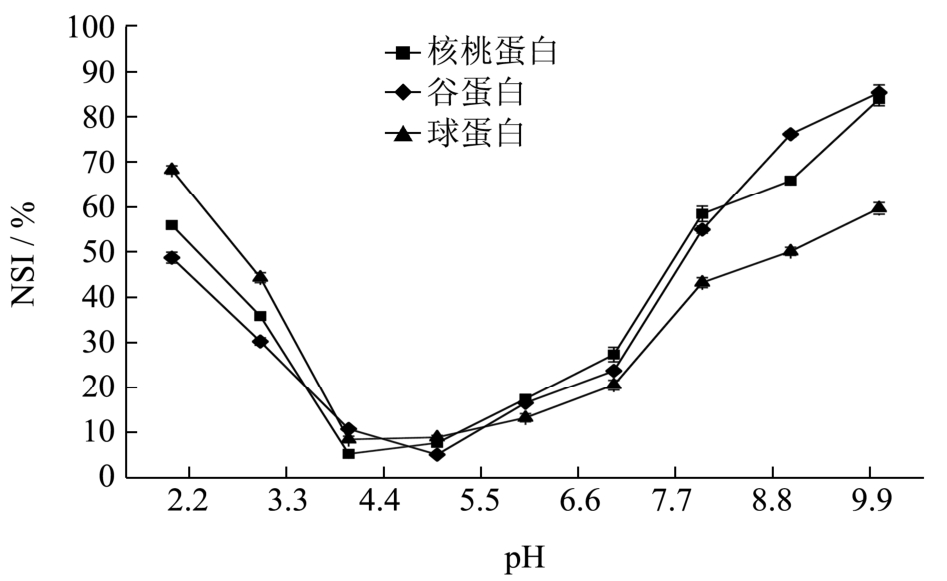
图5 核桃蛋白及其组分氮溶解指数-pH值曲线
Fig.5 Protein solubility of walnut protein and its fractions as a function of pH
2.5 蛋白乳化特性

图6 核桃蛋白及其组分的乳化活性指数-pH值曲线
Fig.6 Emulsifying activity index (EAI) of walnut protein and its fractions as a function of pH
核桃蛋白及其组分的乳化特性与pH的关系如图6和图7所示,乳化活性指数-pH值曲线和乳化稳定性指数-pH值曲线变化趋势相似,都是U型曲线。当pH值在等电点处(4.0~5.0)时,蛋白乳化活性(EAI)及乳化稳定性(ESI)最低,随着pH值偏离等电点,蛋白质乳化活性及乳化稳定性均急剧增加。pH值为10.0时,三种蛋白的乳化稳定性指数均达到最大(约86 min)。谷蛋白整体上表现出较高的乳化活性(但在pH值5.0~7.0时乳化活性较核桃蛋白低),球蛋白的乳化活性最低;核桃蛋白的乳化稳定性最高,而谷蛋白乳化稳定性较低。
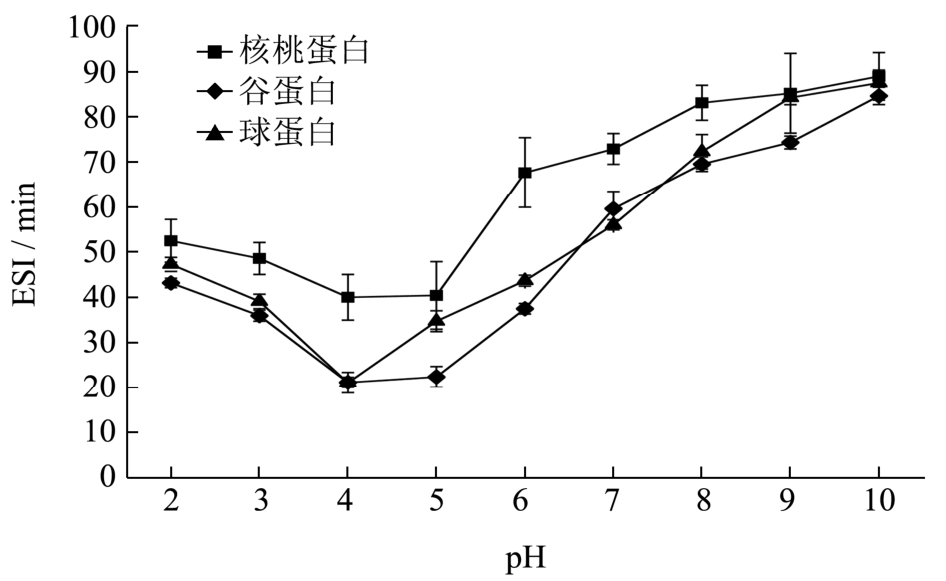
图7 核桃蛋白及其组分的乳化稳定性指数-pH值曲线
Fig.7 Emulsifying stability index (ESI) of walnut protein and its fractions as a function of pH
蛋白质乳化特性是蛋白质溶解度、浓度、表面疏水性、基团带电情况和分子柔性等因素相互作用的结果[11]。当pH值偏离等电点时,蛋白质溶解性增大,电荷增加,蛋白质与极性水分子的作用加强,表面的水化膜厚度增加,蛋白分子柔性和分散性好,使乳化性及乳化稳定性得以提高。球蛋白结构较为疏松,相比于结构紧密的蛋白质,容易在界面上展开和交联,但球蛋白表现出最低的乳化活性,这可能与其表面疏水性比较低有关;核桃蛋白因其具有较紧凑的结构和较高的二硫键含量,故能形成具有较高粘弹性的界面膜,乳化稳定性高;谷蛋白表面疏水性较高,表现出了较高的乳化活性,而乳化稳定性最低,这可能是因为谷蛋白二硫键含量较低,结构较疏松,形成的界面膜强度较低。谷蛋白pH值5.0~7.0时乳化活性较核桃蛋白低,这可能与此时谷蛋白溶解性较差有关。
2.6 蛋白凝胶性质
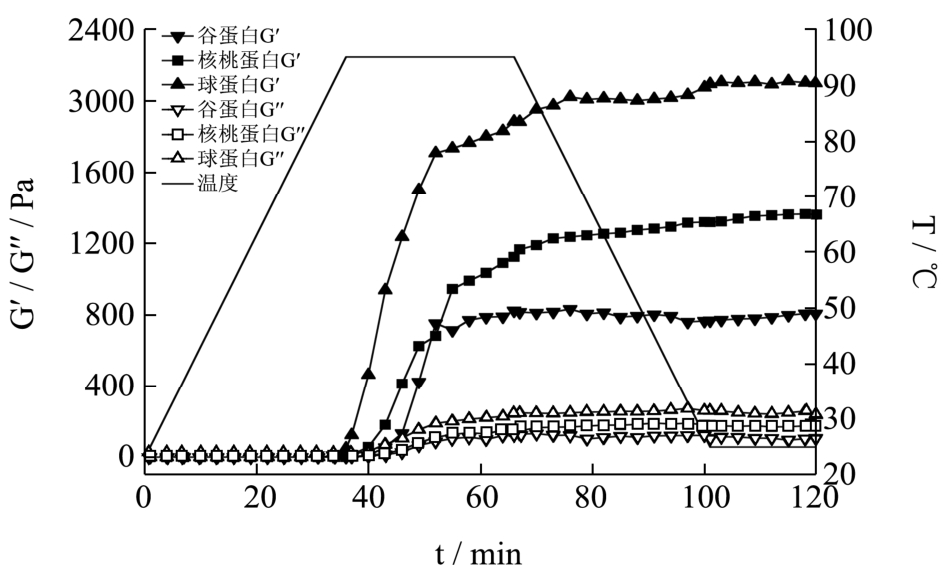
图8 核桃蛋白及其组分的凝胶曲线(pH 7.0)
Fig.8 Heat-induced gelation profiles of walnut protein and its fractions (pH 7.0)
核桃蛋白、球蛋白和谷蛋白凝胶形成过程中弹性模量 G'和粘性模量 G''随加热温度和时间的变化曲线如图8所示,G'和G''的变化趋势基本一致。在升温初期,三种蛋白的G'和G''增加很缓慢;在升温末期和恒温阶段前期(约35 min时),弹性模量G'和G''急剧增大;在约60 min时,蛋白的弹性模量G'和粘性模量G''基本上都达到最大值,此后阶段基本保持恒定,且三种蛋白的弹性模量 G'均约比其粘性模量 G''大一个数量级;此后的频率扫描实验表明G'和G''不随频率的变化而变化。当凝胶形成后,球蛋白粘性模量G''大于核桃蛋白和谷蛋白的粘性模量 G'';球蛋白的 G'(约2100 Pa)约是核桃蛋白的G'(约800 Pa)的三倍,也高于谷蛋白的G'(约1300 Pa),这表明球蛋白有着较强的凝胶形成能力。
蛋白质凝胶过程不仅与蛋白质浓度和体系pH有关,还受疏水相互作用、氢键、静电作用和二硫键等作用力的影响[12]。何志平[13]研究发现在pH 6.0和pH 8.0时,山核桃蛋白最低凝胶浓度为10%,这与本实验中蛋白浓度一致。球蛋白疏水性在三者中较弱,但其巯基含量最高,二硫键含量也比较高,结构松散导致作用位点较多,有利于形成强度较高的凝胶。因为测量仪器能达到的最高温度只有 95 ℃,低于核桃蛋白的变性温度104.42 ℃,核桃蛋白未能完全变性,疏水性基团和巯基没有充分暴露,蛋白分子之间相互作用比较弱,所以核桃蛋白形成的凝胶网络结构强度较低[14]。
本文研究了核桃蛋白及其主要组分谷蛋白和球蛋白的物化性质与功能特性,主要结论如下:
3.1 核桃蛋白比谷蛋白和球蛋白具有更好的热稳定性、更高的二硫键含量和更致密的空间结构。
3.2 谷蛋白和球蛋白的巯基含量较核桃蛋白高,且大部分巯基暴露在表面,而核桃蛋白巯基主要包埋在分子内部;表面疏水性指数由高至低依次为谷蛋白、核桃蛋白和球蛋白。
3.3 在pH值2.0~4.0内,球蛋白的氮溶解指数比核桃蛋白和谷蛋白略高,而在pH值6.0~10.0内球蛋白的氮溶解指数低于两者。谷蛋白乳化活性较高,但乳化稳定性较弱,核桃蛋白的乳化活性较谷蛋白稍差,但乳化稳定性最好;球蛋白的巯基和二硫键含量较高,结构松散,作用位点较多,形成的凝胶强度高,其次就是核桃蛋白和谷蛋白。
参考文献:
[1] Labuckas D, Maestri D, Lamarque A. Effect of different oil extraction methods on proximate composition and protein characteristics of walnut (Juglans regia L.) flour [J]. LWT-Food Science and Technology, 2014, 59(2): 794-799
[2] Venkatachalam M, Roux K H, Sathe S K. Biochemical characterization of soluble proteins in pecan [Carya illinoinensis (Wangenh.)K. Koch] [J]. Journal of Agricultural and Food Chemistry, 2008, 56(17): 8103-8110
[3] Sze-Tao K W C, Sathe S K. Walnuts (Juglans regia L): proximate composition, protein solubility, protein amino acid composition and protein in vitro digestibility [J]. Journal of the Science of Food and Agriculture, 2000, 80(9): 1393-1401
[4] Cofrades S, Serrano A, Ayo J, et al. Characteristics of meat batters with added native and preheated defatted walnut [J]. Food Chemistry, 2008, 107(4): 1506-1514
[5] Mao X, Hua Y. Composition, structure and functional properties of protein concentrates and isolates produced from walnut (Juglans regia L.) [J]. International Journal of Molecular Sciences, 2012, 13(2): 1561-1581
[6] 赵冠里.酶解与多糖接枝改性花生蛋白及其构效机理研究[D].广州:华南理工大学,2011 ZHAO Guan-li. Enzymatic or glycosylation modification of peanut proteins and its related structure-function mechanism [D]. Guangzhou: South China University of Technology, 2011
[7] Yin S W, Tang C H, Cao J S, et al. Effects of limited enzymatic hydrolysis with trypsin on the functional properties of hemp (Cannabis sativa L.) protein isolate [J]. Food Chemistry, 2008, 106(3): 1004-1013
[8] Hogg P J. Disulfide bonds as switches for protein function [J]. Trends in Biochemical Sciences, 2003, 28(4): 210-214
[9] Omana D A, Plastow G, Betti M. The use of β-glucan as a partial salt replacer in high pressure processed chicken breast meat [J]. Food Chemistry, 2011, 129(3): 768-776
[10] Omana D A, Xu Y, Moayedi V, et al. Alkali-aided protein extraction from chicken dark meat: Chemical and functional properties of recovered proteins [J]. Process Biochemistry, 2010, 45(3): 375-381
[11] Deng Q, Wang L, Wei F, et al. Functional properties of protein isolates, globulin and albumin extracted from Ginkgo biloba seeds [J]. Food Chemistry, 2011, 124(4): 1458-1465[12] Romero A, Bengoechea C, Cordobés F, et al. Application of thermal treatments to enhance gel strength and stability of highly concentrated crayfish-based emulsions [J]. Food Hydrocolloids, 2009, 23(8): 2346-2353
[13] 何志平.浙江山核桃抗氧化与蛋白质特性研究[D].杭州:浙江大学,2011 HE Zhi-ping. Study on the functional properties of protein and antioxidant properties of Chinese Hickory (Carya athayensis Sarg.) [D]. Hangzhou: Zhejiang University, 2011
[14] Arogundade L A, Mu T H, Añón M C. Heat-induced gelation properties of isoelectric and ultrafiltered sweet potato protein isolate and their gel microstructure [J]. Food Research International, 2012, 49(1): 216-225
Study on Conformation and Functional Properties of Walnut Protein and its Components
Abstract:The physicochemical and functional properties of walnut protein and its main components (glutelin and globulin) were examined. Walnut protein had a higher denaturation temperature (Td=104.42 ℃) and higher enthalpy (ΔH=12.93 J/g) than glutelin and globulin (p<0.05), with higher cooperativity of thermal transition. Walnut protein had the lowest sulfhydryl content while globulin had the highest. Most sulfhydryl groups of walnut protein were embedded within the molecule and it had the highest content of disulfide bonds (5.2 μmol/g), while those of glutelin and globulin were mostly exposed on the surface. The fluorescence results indicated that walnut protein had a dense tertiary structure, while that of globulin was relatively looser. The descending order of surface hydrophobicity of the three proteins was glutelin, walnut protein, and globulin. The emulsifying stability of walnut protein was the strongest among the three, owing to its compact structure and high disulfide content, whereas glutelin exhibited the worst emulsifying stability. Globulin had a loose structure with more active sites, exhibiting greater gel properties than walnut protein and glutelin.
Key words:walnut protein; glutelin; globulin; physicochemical properties; functional properties
文章篇号:1673-9078(2017)1-48-53
DOI:10.13982/j.mfst.1673-9078.2017.1.008
收稿日期:2016-01-18
基金项目:国家“863”主题项目(2013AA102201)